化学反应理论基础
第一节 热化学方程式
热化学方程式(Thermochemical equations)
即表示化学反应与其热效应关系的方程式。
2H2(g) + O2(g) = 2H2O(l)
△rH

CaCO3(s) = CaO(s) + CO2(g)
△rH

CH3OH(l)+ 3/2 O2(g) = CO2(g) + 2H2O(l)
△cH

哪些反应是吸热的呢?
1.光合作用
2.分解反应
3.铵盐的溶解
哪些反应是放热的呢?
1.燃烧反应
2.化合反应
3.酸与金属反应
第二节 化学反应速率
一、化学反应速率的概念和表示方法
化学反应速率是用单位时间内反应物或生成物浓度变化量的绝对值来表示的。
浓度单位:mol×dm-3,mol·L-1
时间单位:s;min;h
反应速率可选用反应体系中任一物质浓度的变化来表示,因为反应物质变化量之间的关系与化学方程式中计量系数之间的比是一致的。
例题:
在298K下,将2.1mol·dm-3的N2O5充入一密闭容器中,分解反应中各物质浓度变化如下:
2N2O5(g)→4NO2(g)+O2(g)
起始浓度 2.1 0 0
(mol·dm-3)
反应100秒后 1.95 0.3 0.08
(mol·dm-3)
试计算反应开始100秒内的反应速率。
解:分别用N2O5、NO2和O2的浓度变化表示反应速率:
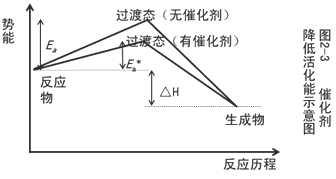
二、反应的活化能与反应热
三、温度对反应速率的影响
温度是影响化学反应的重要因素,各种化学反应的速度和温度的关系比较复杂,一般化学反应,随温度的升高速度加快。
在反应物浓度恒定的情况下,温度每升高10℃,化学反应的速率一般增加2至4倍。
四、催化剂对反应速率的影响
在化学反应中,能显著改变化学反应速率而本身在反应前后其组成、数量和化学性质保持不变的物质叫催化剂。
第三节 化学平衡
一、可逆反应与化学平衡
可逆反应 在同一条件下,既能向正方向又能向相反方向进行的化学反应。
化学平衡 在化学反应中,当正、逆反应速率相等时,反应体系所处的状态叫做化学平衡。
二、化学平衡常数
在一定温度下,当可逆反应达到平衡状态时,生成物浓度幂的乘积与反应物浓度幂的乘积之比为一常数。
对任一可逆反应,如
aA+bB

在一定温度下达到平衡状态时,反应物和生成物的平衡浓度之间都存在着如下关系:
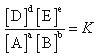
三、平衡常数判断化学反应进行的程度
平衡状态是化学反应进行的最大限度。
此时v正=v逆各种物质的浓度不在随时间改变。
平衡常数K值越大,反应进行的程度越大,即反应物的平衡转化率越大。
平衡常数K值越小,反应进行的程度越小,即反应物的平衡转化率越小。

四、化学平衡的移动
1.浓度对化学平衡的影响
Q ≠ K
在温度不变的条件下,增大(或减少)平衡体系中某物质的浓度,平衡就向减小(或增大)该物质浓度的方向移动。
但不会改变平衡常数的值
aA+bB

2.压力对化学平衡的影响
在温度不变的条件下,增大体系的总压力,平衡向着气体分子数减少的方向移动,减小体系的总压力,平衡向着气体分子数增加的方向移动。
对反应前后气体分子数没有变化的,反应压力对它们的平衡没有影响。
N2(g)+3H2(g)

3.温度对化学平衡的影响
改变平衡系统的温度,则平衡会发生移动,而且平衡常数也会改变。
升高温度,平衡向吸热方向移动;降低温度,平衡向放热反应方向移动。
N2(g)+3H2(g)